 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在970K下,反应起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所
在970K下,反应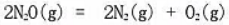 起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在970K下,反应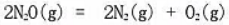 起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
 答案
答案
 更多“在970K下,反应起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所”相关的问题
更多“在970K下,反应起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所”相关的问题
第1题
 试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
第2题
的反应速率之间的关系。
(1)N2+3H2→2NH3
(2)2SO2+O2→2SO3
(3)aA+bB→gG+hH
第4题
第5题
双光气分解反应ClCOOCCl3(g)→2COCl2(g)为一级反应。将一定量 双光气迅速引入一个280℃的容器中,751s后测得系统压力为2.710kPa;经很长时间反应完了后系统压力为4.008kPa。305℃时重复实验,经320s系统压力为2.838kPa;反应完了后系统压力为3.554kPa。求活化能。
第6题
A、是指试剂在使用过程中做的试剂空白吸光度
B、只有在终点法测定时采用
C、是在反应温度下试剂自身吸光度随时间的变化
D、在标本测定过程中同时进行
E、其改变会使测定结果偏低
第7题
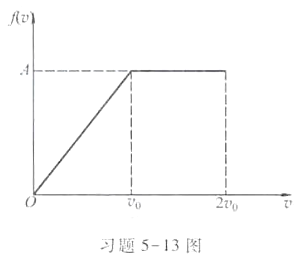
设某系统中N个粒子的速率分布曲线如习题5-13图所示。试求:(1)常量A以v0表示;(2)速率在0~v0之间、1.5 v0~2 v0之间的粒子数;(3)粒子的平均速率;(4)速率在0~v0之间粒子的平均速率。
第8题
第9题
A.平衡常数与温度、压力成正比
B.平衡常数与温度成正比,与压力成反比
C.该反应是一个体积增加的放热反应
D.该反应是一个体积增加的吸热反应